Politiques sur les biologiques biosimilaires

Le comité ACE (Arthritis Consumer Experts) s’informe sur les biosimilaires depuis 2009 et est devenu un leader d’opinion national, organisant des ateliers sur les biosimilaires et partageant des informations avec des groupes multilatéraux à travers le Canada. Le dialogue du comité ACE sur les biosimilaires à travers le Canada a englobé des patients, des professionnels de la santé et des décideurs en matière de politiques au sein du gouvernement et de l’assurance maladie privée.
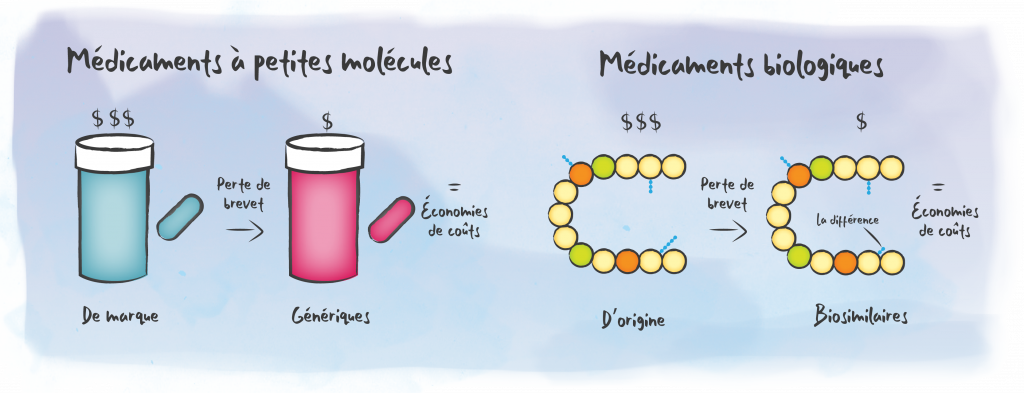
Les dépenses annuelles en médicaments biologiques continuent d’augmenter de façon spectaculaire pour les régimes d’assurance-médicaments publics et privés au Canada. Parallèlement, 55 produits biologiques biosimilaires approuvés par Santé Canada sont maintenant disponibles, y compris des options biosimilaires pour deux des médicaments biologiques d’origine les plus vendus au Canada - Remicade et Humira. Avec un rabais d’environ 40 à 50 % sur le prix des médicaments d’origine (selon la molécule), les biosimilaires offrent des économies importantes aux régimes d’assurance-médicaments privés et publics. En 2022, les biosimilaires représentaient 13,7 % de l’ensemble des dépenses en médicaments biologiques, par rapport à 8,9 % en 2021.[1] Cependant, le Canada se classe bien en dessous de la médiane de l’OCDE pour la pénétration du marché des biosimilaires, ce qui signifie que la plupart de nos régimes d’assurance-médicaments privés et publics n’ont pas réalisé les économies au profit des patients et de leurs systèmes de soins de santé contrairement à de nombreux autres pays comme la Norvège, le Royaume-Uni, l’Italie, la Suède, la France et l’Allemagne.[2] Depuis la commercialisation des médicaments biosimilaires en 2006, les systèmes de santé ont pu réinvestir 25 milliards de dollars d’économies totales dans toute l’Europe.[3]
Les principaux organismes de réglementation dans le monde - notamment l’Agence européenne des médicaments, la Food & Drug Administration aux États - Unis et Santé Canada - soutiennent les transitions bien contrôlées vers les biosimilaires. Les patients doivent savoir que la politique de transition a été mise en œuvre de manière sûre et efficace au cours des 19 dernières années auprès de centaines de milliers de patients atteints de maladies auto-immunes, telles que l’arthrite inflammatoire, dans de nombreux pays d’Europe, sans compromettre la sécurité des patients, l’efficacité ou la qualité des soins.
Au cours des huit dernières années, les régimes d’assurance-médicaments fédéral, provinciaux et territoriaux, de même que les régimes privés d’assurance-médicaments du Canada, ont inscrit les marques biosimilaires avant les médicaments d’origine pour les patients naïfs de traitement (patients qui n’ont pas déjà reçu le médicament d’origine). Depuis 2019, certains régimes d’assurance-médicaments ont également commencé à mettre en œuvre des politiques de transition pour les biosimilaires qui modifient la couverture de certains médicaments biologiques.
Politique de transition vers les biosimilaires au Canada
Dans le contexte de l’utilisation d’un médicament biosimilaire, Santé Canada considère que « le changement entre produits autorisés renvoie au passage de l’utilisation courante d’un produit spécifique à l’utilisation courante d’un autre produit spécifique. Les patients et les fournisseurs de soins de santé peuvent avoir confiance en le fait que les médicaments biosimilaires sont efficaces et sécuritaires pour chacune de leurs indications autorisées ».[4]
Pendant la période de mise en œuvre de la politique de transition, les régimes d’assurance-médicaments couvrent à la fois les médicaments biologiques d’origine et les médicaments biosimilaires pour les maladies concernées, ce qui laisse le temps aux patients de comprendre la transition vers les médicaments biosimilaires et leurs options de traitement avec leurs spécialistes. À la fin d’une période de transition, les régimes d’assurance-médicaments ne couvrent que les versions biosimilaires pour le traitement des maladies concernées par la politique de transition. Les patients qui ne sont pas en mesure de faire la transition ou qui ont une réaction indésirable au biosimilaire peuvent demander une couverture exceptionnelle « d’autorisation spéciale » pour le médicament d’origine.
L’Île-du-Prince-Édouard est devenue la dernière province ou territoire à étendre l’utilisation des biosimilaires en lançant, le 12 octobre 2023, son initiative sur les biosimilaires, dans le cadre de laquelle les personnes couvertes par le régime d’assurance-médicaments de l’Île-du-Prince-Édouard avaient jusqu’au 30 juin 2024 pour collaborer avec leurs fournisseurs de soins de santé afin de passer à une version biosimilaire de leur produit biologique d’origine.[5]
Le 29 mars 2023, le gouvernement du Yukon a annoncé qu’il bonifiait le régime public d’assurance-médicaments en mettant en œuvre une nouvelle politique selon laquelle les Yukonnais concernés inscrits au régime d’assurance-médicaments ou au Programme d’aide aux malades chroniques et aux personnes souffrant d’une incapacité passeraient de leur médicament biologique actuel à un biosimilaire.[6]
Le 24 mars 2023, Terre-Neuve-et-Labrador est devenue la neuvième parmi les provinces et territoires canadiens à mettre en œuvre la politique de transition vers les biosimilaires, qui a permis aux patients de passer de certains produits biologiques d'origine à des versions biosimilaires.[7]
Sylvia Jones, vice-première ministre et ministre de la Santé de l’Ontario, a commenté la mise en œuvre de la politique de transition vers les médicaments biosimilaires : « L’Ontario se joint aux autres provinces et territoires du pays en élargissant l’utilisation de médicaments biosimilaires sûrs et efficaces. Les patients continueront à recevoir le même traitement de haute qualité, tout en permettant au gouvernement de financer davantage de nouvelles pharmacothérapies, d’apporter de l’innovation au système de soins de santé et de poursuivre son travail pour fournir des soins de meilleure qualité et mieux adaptés aux patients. » [8]
À compter du 31 mars 2023, les bénéficiaires du Programme de médicaments de l’Ontario (PMO) qui prennent un médicament biologique d’origine ont commencé à passer gratuitement à une version biosimilaire du médicament approuvée par Santé Canada.[9]
En novembre 2022, la Saskatchewan a lancé son initiative sur les biosimilaires, dans le cadre de laquelle environ 24 000 patients, qui recevaient déjà un produit biologique d’origine, ont fait la transition vers une version biosimilaire.[10]
La Nouvelle-Écosse a annoncé sa nouvelle politique de transition en février 2022, qui concerne les médicaments utilisés pour l’arthrite inflammatoire, les maladies inflammatoires de l’intestin et le psoriasis, ainsi que certaines insulines utilisées pour le traitement du diabète.[11]
En décembre 2021, les Territoires du Nord-Ouest ont lancé une initiative sur les biosimilaires afin de faire passer les patients des médicaments biologiques d'origine aux versions biosimilaires. Les économies prévues grâce à la mise en œuvre de cette politique doivent être réinvesties pour aider à financer la couverture en augmentant le nombre de médicaments couverts à l’avenir par les programmes de prestations complémentaires de santé.[12]
En mai 2021, le Québec a modifié la couverture de certains médicaments d’origine par le régime public d’assurance médicaments et a exigé que les patients passent du médicament d’origine qu’ils prennent à une version biosimilaire de ce médicament.[13]
En avril 2021, le Nouveau-Brunswick a lancé son initiative sur les biosimilaires, qui consiste à faire passer les patients des médicaments biologiques d’origine à leurs versions biosimilaires.[14]
En décembre 2019, l’Alberta a annoncé son initiative sur les biosimilaires afin d’étendre l’utilisation des médicaments biosimilaires au moyen d’une politique de transition, expliquant que « les patients continueront à recevoir le même traitement sûr et efficace, mais à un coût moindre. »[15]
En mai 2019, la Colombie-Britannique a été la première province à mettre en œuvre une politique de transition vers les biosimilaires. Depuis la mise en œuvre, la Colombie-Britannique a signalé que des milliers de patients atteints d’arthrite inflammatoire, de diabète et de maladie intestinale inflammatoire ont fait la transition en toute sécurité.[16] Grâce au lancement de sa politique de transition vers les biosimilaires, la Colombie-Britannique a déclaré qu’elle améliorait la durabilité de son programme PharmaCare en ajoutant de nouvelles listes de médicaments et en renforçant la couverture des médicaments existants pour les patients.[17]
Pour obtenir des information à jour sur les politiques relatives aux biosimilaires de chaque régime public d’assurance-médicaments provincial et territorial, veuillez cliquer ici.
Pourquoi les régimes publics d’assurance-médicaments font-ils passer les patients d’un produit biologique d’origine à un produit biologique biosimilaire ?
L’un des principaux avantages de la transition des patients est la réalisation de centaines de millions de dollars d’économies pour le système de soins de santé. Les biosimilaires ont le potentiel d’améliorer l’accès aux médicaments biologiques (tant les médicaments d’origine que les biosimilaires) et de faire économiser des milliards de dollars aux systèmes de soins de santé publics et privés, dès maintenant et au cours des années à venir.
Une étude commandée par le Conseil d’examen du prix des médicaments brevetés (CEPMB) du gouvernement canadien a estimé que les régimes d’assurance-médicaments privés et publics du Canada pourraient économiser entre 332 millions et 1,81 milliard de dollars canadiens au cours de la 3e année suivant l’introduction d’un biosimilaire dans un portefeuille de produits.[18]
Selon le Réseau de recherche sur les politiques en matière de médicaments de l’Ontario : « L’utilisation et les dépenses publiques en matière de médicaments biologiques continuent à croître en Ontario, avec des dépenses annuelles prévues de près de 1,4 milliard de dollars en 2021. En revanche, l’adoption des biosimilaires a été faible, moins d’un utilisateur de médicaments biologiques sur cinq ayant accès à ces médicaments moins coûteux lorsqu’ils sont disponibles. Il convient d’explorer les initiatives susceptibles d’accroître l’utilisation des biosimilaires compte tenu de l’important potentiel d’économies pour le gouvernement.[19]
Le Conseil d’examen du prix des médicaments brevetés estime que l’Ontario pourrait économiser plus de 200 millions de dollars par année grâce à la mise en œuvre de sa politique de transition vers les biosimilaires.[20] Lors de l'annonce du lancement, le gouvernement de l'Ontario a déclaré que la politique de transition vers les biosimilaires permettrait à l'Ontario d'investir davantage dans les pharmacothérapies nouvelles et innovantes et de continuer à élargir la liste des médicaments vitaux financés par la province.
Lors de l’annonce de la 3e phase de l’expansion de son programme d’initiative sur les biosimilaires en août 2020, le gouvernement de la Colombie-Britannique a déclaré que la prochaine phase lui permettrait de réinjecter 30,7 millions de dollars supplémentaires au cours des trois prochaines années, en plus des 96,6 millions de dollars provenant des phases précédentes de l’initiative sur les biosimilaires, dans le système de soins de santé de la Colombie-Britannique. [21] En avril 2021, le gouvernement de la Colombie-Britannique a ajouté un autre biosimilaire (adalimumab) à la couverture provinciale, invoquant des économies supplémentaires de plus de 100 millions de dollars sur trois ans.[22]
Lorsqu’il a annoncé sa politique de transition vers les biosimilaires en décembre 2019, le gouvernement de l’Alberta a déclaré que le passage aux biosimilaires permettrait d’économiser entre 227 et 380 millions de dollars au cours des 4 prochaines années, une fois la mise en œuvre terminée.[23] La politique québécoise en matière de biosimilaires devrait générer des économies annuelles de 100 millions de dollars d’ici 2022, économies qui seront réinvesties dans le système de soins de santé du Québec et contribueront d’améliorer l’accès aux médicaments novateurs.[24] En Saskatchewan, le ministère de la Santé estime que la province réalisera des économies annuelles d’environ 20 millions de dollars lorsque les patients auront terminé la transition vers les biosimilaires d’ici le 1er mai 2023.[25]
Politiques actuelles en matière de biologiques biosimilaires au Canada
Politiques actuelles en matière de biologiques biosimilaires au Canada
Les régimes publics et privés adoptent des politiques sur les biosimilaires qui touchent les Canadiennes et les Canadiens atteints de nombreuses maladies chroniques invalidantes et potentiellement mortelles, comme l’arthrite inflammatoire, le cancer, le diabète, la maladie intestinale inflammatoire, la sclérose en plaques, la maladie de Crohn, le psoriasis et la dégénérescence maculaire liée à l’âge.
Pour obtenir des informations à jour sur les politiques relatives aux biosimilaires pour chaque liste de médicaments remboursables par les régimes publics, veuillez consulter les sites Web ci-dessous :
Colombie-Britannique
Biosimilars Initiative for Patients (en anglais seulement)
BC PharmaCare (en anglais seulement)
Alberta
Initiative sur les biosimilaires (en anglais seulement)
Alberta : Biosimilars drugs (en anglais seulement)
Alberta Health Interactive Drug Benefit List Page (en anglais seulement)
Saskatchewan
Saskatchewan Biosimilars Initiative (en anglais seulement)
Manitoba
Notice - Tiered Biologics Reimbursement Policy (en anglais seulement)
Provincial Drug Formulary (en anglais seulement)
Nouvelle-Écosse
Information for patients about biosimilars (en anglais seulement)
Nova Scotia Pharmacare Program (en anglais seulement)
Terre-Neuve-et-Labrador
Île-du-Prince-Édouard
Initiative sur les médicaments biosimilaires de Î.-P.-É.
PEI Formulary (en anglais seulement)
Territoires du Nord-Ouest
Yukon
Politique du Yukon en matière de médicaments biosimilaires
Yukon Formulary (en anglais seulement)
Services de santé non assurés (SSNA)
Références
[1] Institut canadien d’information sur la santé. Dépenses en médicaments prescrits au Canada, 2022. ICIS : 2023. Infographie
https://www.cihi.ca/fr/depenses-en-medicaments-prescrits-au-canada-2023
[2] Conseil d’examen du prix des médicaments brevetés – Les médicaments biologiques au Canada. Partie 1 : tendances du marché
[3] The impact of biosimilar competition in Europe, IQVIA (2021) (en anglais seulement)
https://www.medicinesforeurope.com/wp-content/uploads/2022/05/Facts-and-figures-BIOS-2022.pdf
[4] Santé Canada – Médicaments biologiques biosimilaires au Canada : fiche d’information.
[5] Initiative sur les médicaments biosimilaires de l’Î.-P.-É.
https://www.princeedwardisland.ca/fr/service/initiative-medicaments-biosimilaires-li-p-e
[6] Site Web du gouvernement du Yukon: Soutien aux patients dans la transition aux médicaments biosimilaires
[7] NLPDP Biosimilar Initiative (en anglais seulement)
https://www.gov.nl.ca/hcs/prescription/biosimilars/
[8] L'Ontario élargit l'utlisation sécuritaires des médicaments biosimilaires
https://news.ontario.ca/fr/release/1002611/ontario-expanding-safe-use-of-biosimilars
[9] Ministère de la Santé de l’Ontario : Médicaments biosimilaires – Information pour les patients
https://www.ontario.ca/fr/page/biosimilaires
[10] Saskatchewan Biosimilars Initiative (en anglais seulement)
[11] Nova Scotia biosimilars initiative (en anglais seulement)
https://novascotia.ca/news/release/?id=20220204002
[12] Initiative sur les médicaments biosimilaires des Territoires du Nord-Ouest
https://www.hss.gov.nt.ca/fr/services/initiative-sur-les-m%C3%A9dicaments-biosimilaires
[13] Le ministère de la Santé et des Services Sociaux – Assurance médicaments
https://www.ramq.gouv.qc.ca/fr/citoyens/assurance-medicaments/connaitre-conditions-couverture-regime
[14] Nouveau-Brunswick - L’initiative sur les biosimilaires pour les patients
[15] Alberta Health: Biosimilar Drugs (en anglais seulement)
https://www.alberta.ca/biosimilar-drugs.aspx
[16] B.C. Ministry of Health: Biosimilars Initiative for Patients - History of previous biosimilar listings (en anglais seulement)
[17] British Columbia Ministry of Health: Biosimilars Initiative (en anglais seulement)
https://news.gov.bc.ca/releases/2019HLTH0080-001072
[18] Conseil d’examen du prix des médicaments brevetés, Gouvernement du Canada. Affiche : Économies potentielles associées aux biosimilaires au Canada.
http://www.pmprb-cepmb.gc.ca/CMFiles/NPDUIS/2017_Conference_Posters/post_6_biosim.pdf
[19] Tadrous M, McCormack D, Martins D, Kitchen S, Singh S, Gomes T. Current and Prospective Utilization of Innovator Biologics and Biosimilars in Ontario. Toronto: Ontario Drug Policy Research Network; Janvier 2020. (en anglais seulement)
[20] Conseil d’examen du prix des médicaments brevetés, « Les médicaments biosimilaires au Canada : un élan dans le sillage des récentes politiques de substitution »
[21] B.C. Government News: B.C. expands biosimilar program (en anglais seulement)
https://news.gov.bc.ca/releases/2020HLTH0257-001569
[22] B.C.'s biosimilars program expands (en anglais seulement)
https://news.gov.bc.ca/releases/2021HLTH0067-000653
[23] Alberta Biosimilars Initiative (en anglais seulement)
https://www.alberta.ca/biosimilar-drugs.aspx
[24] Le ministre Christian Dubé annonce un virage vers les médicaments biosimilaires, Québec, le 18 mai 2021 (en français seulement)
https://www.msss.gouv.qc.ca/ministere/salle-de-presse/communique-2864/
[25] Saskatchewan Launches Biosimilars Initiative (en anglais seulement)
Quelles sont les positions du comité ACE en matière de politiques sur les biologiques biosimilaires au Canada ?
Quelles sont les positions du comité ACE en matière de politiques sur les biologiques biosimilaires au Canada ?
La perspective organisationnelle du comité ACE sur les biosimilaires évolue au même rythme que les politiques encadrant leur usage et les résultats de la recherche publiés dans les revues médicales dont le comité de lecture est formé par des pairs. Comme toujours, le comité ACE s’appuiera sur des preuves. La mission du comité ACE est de continuer d’offrir à nos membres, nos abonnés et au public l’information et des programmes éducatifs fondés sur les plus récents développements de la recherche. Nos principes directeurs ont toujours comporté et comportent encore l’obligation de nous appuyer sur les preuves scientifiques de notre champ thérapeutique. Reposant essentiellement sur l’évaluation par des pairs, des recherches bien conçues et la méta-analyse actuelle, notre perspective s’articule autour des éléments suivants :
- Les patients atteints de formes d’arthrite inflammatoire devraient exiger et sont en droit de s’attendre aux meilleurs soins possibles grâce au partage de la prise de décision entre eux-mêmes, leur rhumatologue et les autres fournisseurs de soins de santé;
- Les biosimilaires peuvent présenter des avantages par rapport à leurs biologiques d’origine en raison notamment d’améliorations des procédés de fabrication et d’administration;
- La politique de remboursement des biologiques biosimilaires a le potentiel requis pour faire économiser des milliards de dollars aux systèmes de soins de santé publics et privés, aujourd’hui et au cours des années à venir;
- Plus de 16 ans d’expérience clinique démontrent que les biosimilaires approuvés par l’Agence européenne de médicaments peuvent être aussi efficaces et sécuritaires dans les indications approuvées que leurs produits d’origine;
- L’élaboration d’une politique relative aux biosimilaires dans le traitement de l’arthrite inflammatoire devrait inclure la participation crédible et impartiale de patients et de rhumatologues prêts à divulguer leur source de financement provenant des fabricants des produits affectés par cette politique;
- Les patients devraient pouvoir évaluer les risques et les avantages de prendre (ou non) un médicament et disposer des outils nécessaires leur permettant de discuter avec leur équipe de soins des avantages et désavantages de tous les médicaments envisagés;
- Une politique de transition est appropriée lorsque le médecin prescripteur et son patient ont accès aux outils d’éducation et d’information nécessaires au soutien du patient dans toutes les facettes de l’accès au biosimilaire recommandé, de « l’encadrement des soins » à de l’aide pour remplir les documents d’assurance privée ou du régime d’assurance public, en passant par le choix d’une clinique d’infusion ou d’une pharmacie et par l’observance thérapeutique;
- Le gouvernement devrait réinvestir en temps opportun les économies générées par cette politique de transition dans de nouveaux médicaments inscrits aux régimes d’assurance-médicaments pour combler les besoins thérapeutiques non encore satisfaits, dans la révision et l’assouplissement des critères de remboursement des biologiques et des ARMM afin de les rendre plus accessibles et dans la mise en place de certains éléments importants des modèles de soins de l’arthrite inflammatoire tels que l’instauration de codes de facturation pour soins infirmiers en rhumatologie;
- Les résultats des traitements devraient être recueillis chez les patients ayant subi des transitions multiples entre les biosimilaires et leurs biologiques d’origine.
Comparaison des politiques sur les biologiques biosimilaires : Canada, É.-U. et Union européenne
Avez-vous des questions à propos de la politique sur les biologiques biosimilaires ?
Les régimes d’assurance-médicaments des provinces et des assureurs offrent le remboursement d’un nombre toujours plus croissant de biosimilaires approuvés par Santé Canada. Si vous avez des questions sur les politiques ou initiatives en matière de biosimilaires là où vous habitez, veuillez contacter le comité ACE à l’adresse suivante : feedback@jointhealth.org.
Avez-vous des questions à propos de la politique sur les biologiques biosimilaires ?
Les régimes d’assurance-médicaments des provinces et des assureurs offrent le remboursement d’un nombre toujours plus croissant de biosimilaires approuvés par Santé Canada. Si vous avez des questions sur les politiques ou initiatives en matière de biosimilaires là où vous habitez, veuillez contacter le comité ACE à l’adresse suivante : feedback@jointhealth.org.
Avez-vous des questions à propos de la politique sur les biologiques biosimilaires ?
Les régimes d’assurance-médicaments des provinces et des assureurs offrent le remboursement d’un nombre toujours plus croissant de biosimilaires approuvés par Santé Canada. Si vous avez des questions sur les politiques ou initiatives en matière de biosimilaires là où vous habitez, veuillez contacter le comité ACE à l’adresse suivante : feedback@jointhealth.org.

Arthritis Consumer Experts
© 2000-2023 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM

Arthritis Consumer Experts
© 2000-2021 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM


Arthritis Consumer Experts
© 2000-2021 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM











